Mercredi, Kendric Cromer, un garçon de 12 ans originaire d’une banlieue de Washington, est devenu la première personne au monde atteinte de drépanocytose à commencer une thérapie génique commercialement approuvée qui pourrait guérir cette maladie.
Pour les quelque 20 000 personnes atteintes de drépanocytose aux États-Unis qui remplissent les conditions requises pour bénéficier du traitement, le début du parcours médical de Kendric, qui s’étendra sur plusieurs mois, peut offrir de l’espoir. Mais cela témoigne également des difficultés auxquelles les patients sont confrontés lorsqu’ils recherchent deux nouveaux traitements contre la drépanocytose.
Pour quelques chanceux, comme Kendric, le traitement pourrait leur permettre de vivre la vie à laquelle ils aspirent tant. Adolescent solennel et timide, il avait appris que les activités ordinaires – faire du vélo, sortir par une journée froide, jouer au football – pouvaient provoquer des épisodes de douleur brûlante.
« La drépanocytose vole toujours mes rêves et interrompt toutes les choses que je veux faire », a-t-il déclaré. Maintenant, il a l’impression qu’il a une chance de mener une vie normale.
Vers la fin de l’année dernière, la Food and Drug Administration a autorisé deux sociétés à vendre une thérapie génique aux personnes atteintes de drépanocytose – une maladie génétique des globules rouges qui provoque des douleurs débilitantes et d’autres problèmes médicaux. Aux États-Unis, on estime que 100 000 personnes sont atteintes de drépanocytose, pour la plupart noires. Les personnes naissent avec la maladie lorsqu’elles héritent du gène muté correspondant à la maladie de chaque parent.
Le traitement a aidé les patients dans les essais cliniques, mais Kendric est le premier patient commercial de Bluebird Bio, une société de Somerville, Massachusetts. Une autre société, Vertex Therapeutics de Boston, a refusé de dire si elle avait commencé un traitement pour des patients avec son remède approuvé basé sur l’édition génique CRISPR.
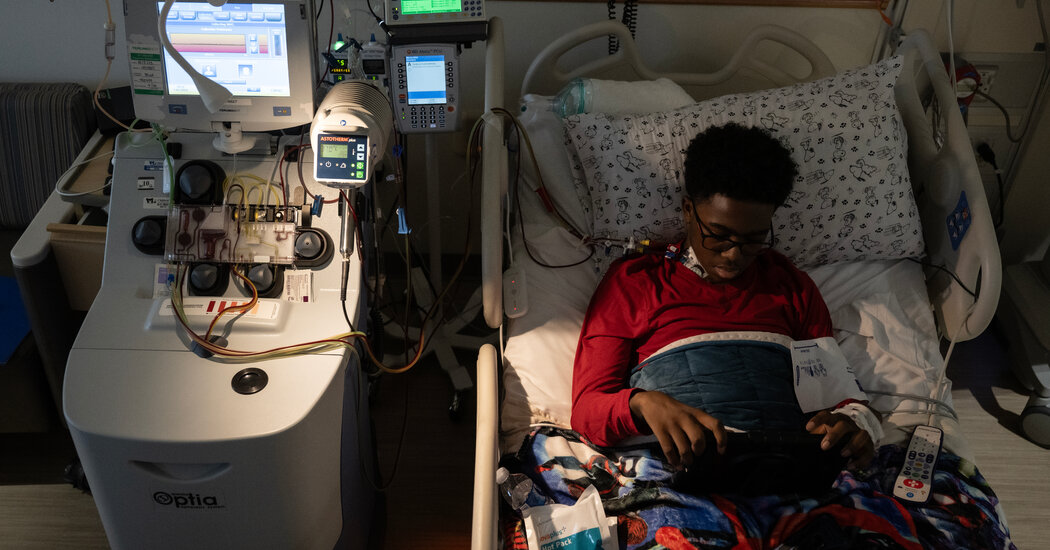
Kendric – dont l’assurance maladie de la famille a accepté de couvrir la procédure – a commencé son traitement au Children’s National Hospital de Washington. Le traitement de mercredi n’était que la première étape. Les médecins lui ont prélevé des cellules souches de moelle osseuse, que Bluebird va ensuite modifier génétiquement dans un laboratoire spécialisé pour son traitement.
Cela prendra des mois. Mais avant de commencer, Bluebird a besoin de centaines de millions de cellules souches de Kendric, et si la première collecte – qui prend six à huit heures – n’est pas suffisante, l’entreprise essaiera une ou deux fois de plus.
S’il n’en a toujours pas assez, Kendric devra passer encore un mois à préparer une autre extraction de cellules souches.
L’ensemble du processus est si complexe et prend tellement de temps que Bluebird estime pouvoir traiter les cellules de seulement 85 à 105 patients chaque année – et cela inclut non seulement les patients drépanocytaires, mais également les patients atteints d’une maladie beaucoup plus rare – la bêta-thalassémie – qui peuvent recevoir une thérapie génique similaire.
Les centres médicaux ont également la capacité de prendre en charge un nombre limité de patients traités par thérapie génique. Chaque personne a besoin de soins experts et intensifs. Une fois les cellules souches traitées, le patient doit rester à l’hôpital pendant un mois. La plupart du temps, les patients sont gravement malades à cause d’une chimiothérapie puissante.
Children’s National ne peut accepter qu’environ 10 patients par an en thérapie génique.
« C’est un gros effort », a déclaré le Dr David Jacobsohn, chef de la division des transplantations de sang et de moelle osseuse du centre médical.
En tête de la liste d’attente
La semaine dernière, Kendric s’est préparé pour la collecte de cellules souches. Il a passé de nombreuses semaines dans cet hôpital, soigné pour une douleur si intense que lors de sa dernière visite, même la morphine et l’oxycodone n’ont pas pu la contrôler. Il a apporté son oreiller spécial avec une taie d’oreiller Snoopy que sa grand-mère lui a offerte et sa couverture spéciale Spider-Man. Et il avait un objectif.
« Je veux être guéri », a-t-il déclaré.
Les cellules souches de la moelle osseuse, source de tous les globules rouges et blancs du corps, sont normalement nichées dans la moelle osseuse d’une personne. Mais les médecins de Kendric lui ont administré un médicament, le plérixafor, qui les a libérés et les a laissés flotter dans son système circulatoire.
Pour isoler les cellules souches, des membres du personnel de l’hôpital ont inséré un cathéter dans une veine de la poitrine de Kendric et l’ont attaché à un appareil d’aphérèse, un appareil en forme de boîte situé à côté de son lit d’hôpital. Il fait tourner le sang et le divise en couches : une couche de plasma, une couche de globules rouges et une couche de cellules souches.
Une fois que suffisamment de cellules souches auront été collectées, elles seront envoyées au laboratoire de Bluebird à Allendale, dans le New Jersey, où les techniciens ajouteront un gène d’hémoglobine sain pour corriger les gènes mutés à l’origine de sa drépanocytose.
Ils renverront les cellules modifiées trois mois plus tard. L’objectif est de donner à Kendric des globules rouges qui ne se transformeront pas en forme de croissant fragile et ne resteront pas coincés dans ses vaisseaux sanguins et ses organes.
Bien qu’il ne faille que quelques jours pour ajouter un nouveau gène aux cellules souches, il faut des semaines pour effectuer des tests de pureté, d’activité et de sécurité. Les techniciens doivent faire croître les cellules en laboratoire avant d’effectuer ces tests.
Bluebird annonce un prix de 3,1 millions de dollars pour sa thérapie génique, appelée Lyfgenia. C’est l’un des prix les plus élevés jamais enregistrés pour un traitement.
Malgré le prix astronomique et le processus épuisant, les centres médicaux ont des listes d’attente de patients espérant être soulagés d’une maladie qui peut provoquer des accidents vasculaires cérébraux, des lésions organiques, des lésions osseuses, des épisodes de douleurs atroces et une vie raccourcie.
Au Children’s National, le Dr Jacobsohn a déclaré qu’au moins 20 patients étaient éligibles et intéressés. Le choix de qui partirait en premier dépendait de celui qui était le plus malade et de qui était assuré.
Kendric s’est qualifié sur les deux points. Mais même si son assurance a rapidement approuvé le traitement, les paiements d’assurance ne représentent qu’une partie de ce que cela coûtera à sa famille.
Chances et espoirs
Deborah Cromer, une agente immobilière, et son mari, Keith, qui travaille dans les forces de l’ordre pour le gouvernement fédéral, ne savaient pas qu’ils pourraient avoir un enfant drépanocytaire.
Ils ne l’ont découvert que lorsque Deborah était enceinte de Kendric. Les tests ont montré que leur bébé aurait une chance sur quatre d’hériter du gène muté de chaque parent et d’être atteint de drépanocytose. Ils pourraient interrompre la grossesse ou tenter leur chance.
Ils ont décidé de tenter leur chance.
La nouvelle que Kendric souffrait de drépanocytose a été dévastatrice.
Il a eu sa première crise quand il avait 3 ans. Des cellules sanguines falciformes étaient restées coincées dans ses jambes et ses pieds. Leur bébé était inconsolable, tellement souffrant que Deborah ne pouvait même pas le toucher.
Elle et Keith l’ont emmené au Children’s National.
«Nous ne savions pas que c’était notre introduction à de nombreuses visites aux urgences», a déclaré Deborah.
Les crises douloureuses devenaient de plus en plus graves. Il semblait que tout pouvait les déclencher : 10 minutes de volley-ball, un plongeon dans une piscine. Et lorsqu’ils se produisaient, Kendric avait parfois besoin de cinq jours à une semaine de traitement à l’hôpital pour contrôler sa douleur.
Ses parents sont toujours restés avec lui. Deborah dormait sur un banc étroit dans la chambre d’hôpital. Keith dormait sur une chaise.
« Nous n’aurions jamais songé à le quitter. » » dit Déborah.
Finalement, la maladie a commencé à causer de graves dégâts. Kendric a développé une nécrose avasculaire de ses hanches – une mort osseuse qui survient lorsque les os sont privés de sang. La maladie s’est propagée à son dos et à ses épaules. Il a commencé à prendre une dose quotidienne importante de gabapentine, un médicament contre les douleurs nerveuses.
Sa douleur ne s’est jamais calmée. Un jour, il a dit à Deborah : « Maman, j’ai mal tous les jours. »
Kendric veut être comme les autres enfants, mais la peur des crises douloureuses l’a retenu. Il est devenu de plus en plus sédentaire, passant ses journées sur son iPad, à regarder des anime ou à construire des structures Lego élaborées.
Malgré ses nombreuses absences, Kendric a maintenu ses études, conservant une moyenne de A.
Deborah et Keith ont commencé à espérer une thérapie génique. Mais lorsqu’ils ont découvert ce que cela coûterait, ils ont perdu un peu de leur espoir.
Mais leur assureur a approuvé le traitement au bout de quelques semaines, ont-ils précisé.
Maintenant, cela a commencé.
«Nous avons toujours prié pour que ce jour vienne», a déclaré Deborah. Mais, a-t-elle ajouté, « nous sommes nerveux en lisant les consentements et ce qu’il devra traverser. »
Kendric, cependant, regarde avec impatience l’avenir. Il veut devenir généticien.
Et il a dit : « Je veux jouer au basket-ball. »

Archie Mitchell, with a prestigious master’s degree from France and two decades of experience, is an authority in his field, renowned for making complex subjects engaging through his blog. At 49, he seamlessly merges academic knowledge with practical insights, aimed at educating and empowering his audience. Beyond his professional life, Archie’s hobbies and personal interests add depth to his writing, making it a valuable resource for both professionals and enthusiasts looking to expand their understanding.


